Identificador único de dispositivo (UDI)
Servicios globales
Home / Etiquetas UDI (identificador único de dispositivos)
Etiquetas UDI (identificador único de dispositivos)
El día 24 de septiembre de 2013, la Administración de Alimentos y Medicamentos (FDA) estadounidense publicó una regla final que requería que la mayoría de los dispositivos médicos distribuidos en Estados Unidos llevaran identificadores únicos de dispositivo (UDI). El sistema de UDI facilita la identificación de los dispositivos médicos, la trazabilidad y el seguimiento a través de la distribución y el uso. La regla requiere que la información del producto perteneciente a los dispositivos se envíe a la Base de datos de identificación única de dispositivos global (GUDID) de la FDA.
Además, la regla también requiere que se coloque un formato de fecha nuevo y estandarizado en todas las etiquetas de los dispositivos médicos.
Masimo ha actualizado su etiqueta para que cumpla con la regulación sobre el UDI y los estándares GS1.
Si tiene alguna pregunta que no aparezca en estas Preguntas frecuentes, póngase en contacto con Servicio al cliente:
EE. UU.: customerorders@masimo.com
Fuera de EE. UU.: emeasales@masimo.com
Preguntas frecuentes
Preguntas frecuentes
1. ¿Qué es el UDI?
Un identificador único de dispositivo (UDI) es una serie de caracteres alfanuméricos o numéricos basados en un estándar de codificación global que identifica de forma adecuada un dispositivo en el momento de la distribución y del uso. Un UDI está compuesto de:
- Un identificador de dispositivo, el GTIN (número de artículo comercial global): un parte fija y obligatoria de un UDI que identifica la versión específica o el modelo de dispositivo y el etiquetador de ese dispositivo; y
- Un identificador de producción: una parte condicional y variable de un UDI que identifica uno o más de los aspectos siguientes cuando se incluye en la etiqueta del dispositivo:
- El lote de producción en el que se fabricó el dispositivo;
- El número de serie de un dispositivo específico;
- La fecha de vencimiento de un dispositivo específico; o
- La fecha en la que se fabricó un dispositivo específico.
Masimo utiliza GS1 como su agencia acreditada para la asignación de códigos de barras y estructuras de códigos de barras.
Tenga en cuenta que los productos que NO estén clasificados como dispositivos médicos no tendrán que contener el código de barras.
2. ¿Quién tiene que cumplir con las regulaciones del UDI?
Todas las empresas de dispositivos médicos deben cumplir con las regulaciones sobre el UDI.
3. ¿Cuál es la planificación de implementación para el cumplimiento de las regulaciones sobre el UDI?
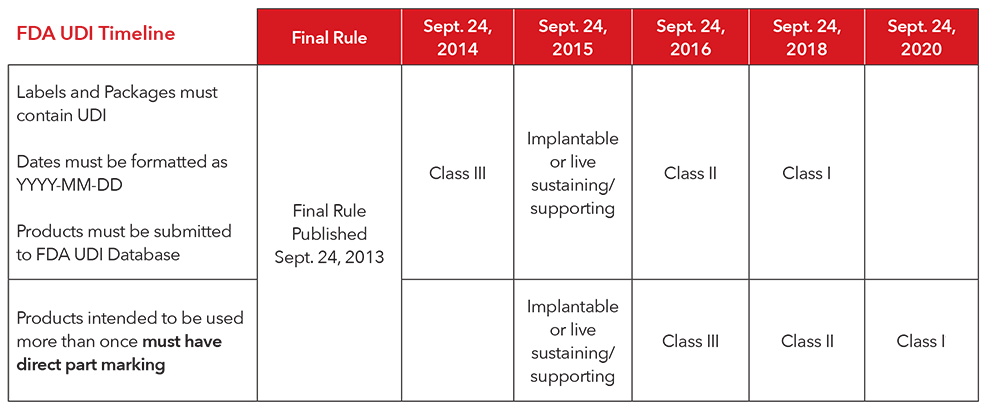
** Masimo está aplicando la marcación directa de las piezas de todos los productos reutilizables de forma voluntaria. No es necesario aplicar la marcación directa de los productos Masimo según la regla actual de la FDA.
4. ¿Cómo Masimo cumple con el UDI?
Masimo distribuye productos de Clase II y algunos de Clase I. Masimo ha actualizado su etiqueta para que cumpla con la regulación del UDI y los estándares GS1.
Tenga en cuenta que los productos que NO estén clasificados como dispositivos médicos no tendrán que contener el código de barras.
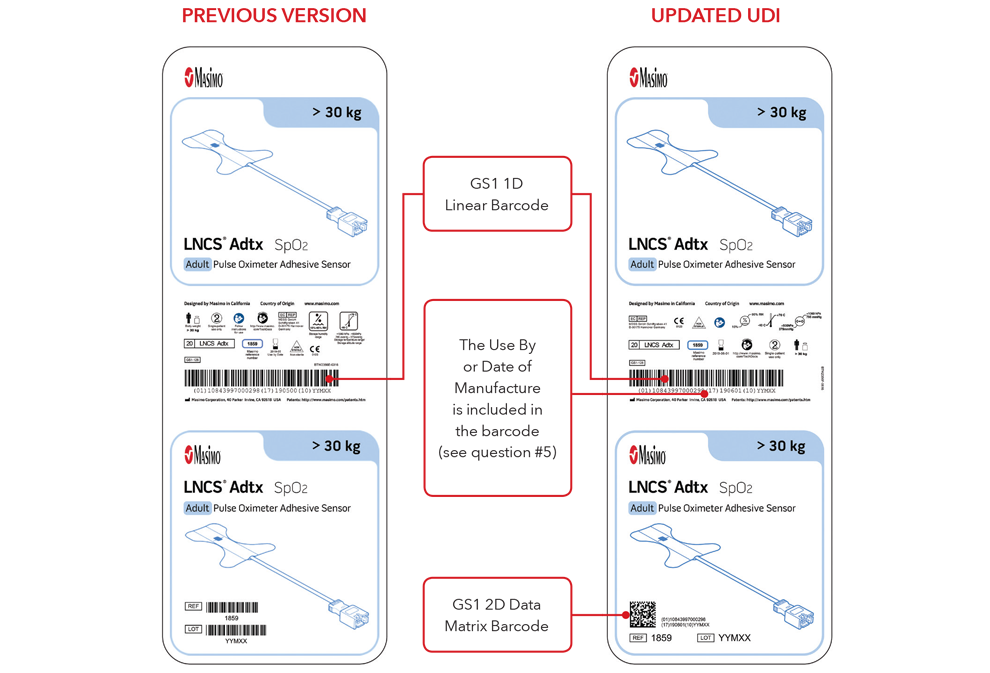
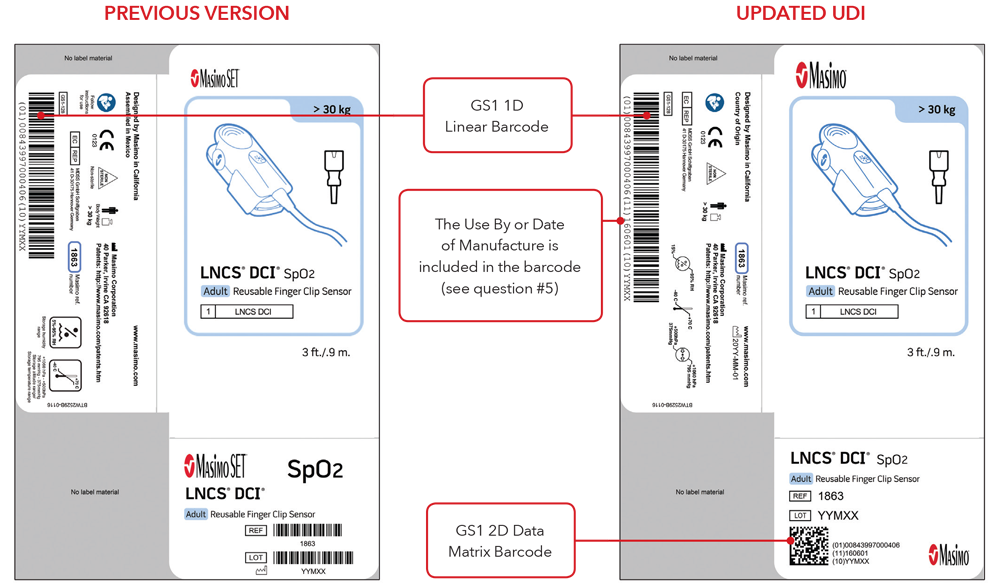
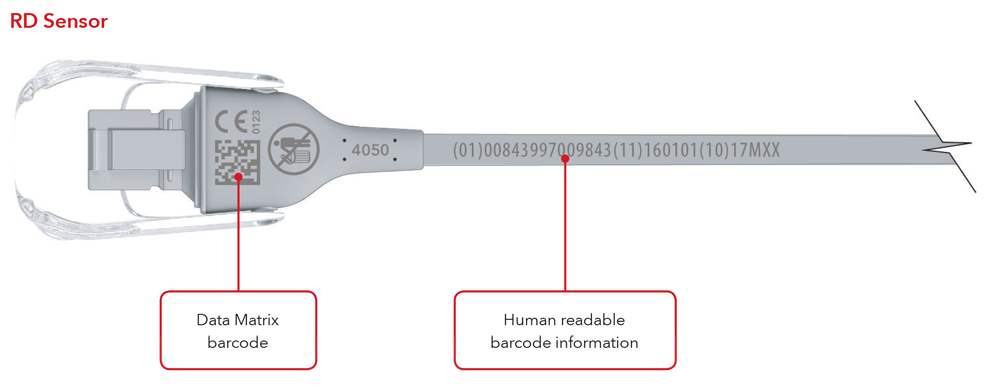
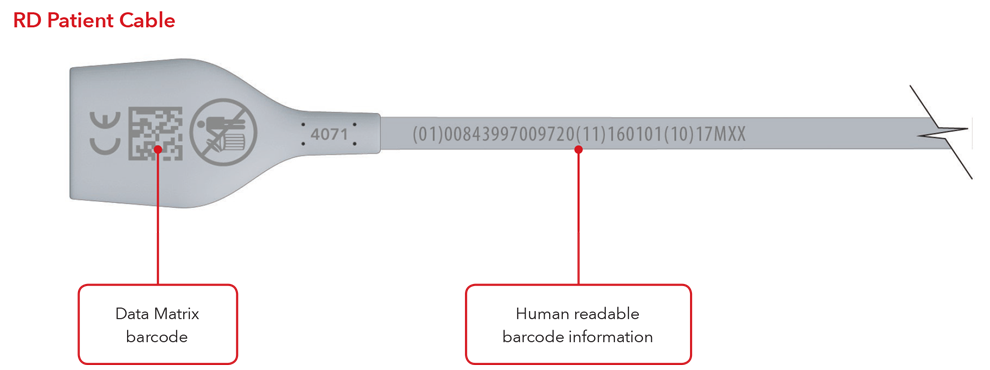
5. ¿Cuál será el aspecto de la etiqueta de UDI y de la marcación directa de la pieza?
A continuación se muestran ejemplos:
- Etiquetas de la caja del sensor con la versión anterior y con las etiquetas UDI actualizadas
- Sensor con la marcación directa de la pieza
- Cable con la marcación directa de la pieza
Nota importante: según el tipo de producto, la etiqueta contendrá una de las siguientes dos fechas. Para productos que tengan una fecha de caducidad, aparecerá AAAA-MM-DD debajo del símbolo de caducidad y se codificará como AAMMDD precedido por la producción identificada (17) dentro de los códigos de barras GS1 y 2D. Para productos que no tengan una fecha de caducidad, la fecha de fabricación aparecerá como AAAA-MM-DD junto a la fecha del símbolo de fabricación y se codificará como AAMMDD precedido por el identificador de producción (11) dentro de los códigos de barras GS1 y 2D.
Ejemplos de etiqueta de caja del sensor
Sensor y cable con ejemplos de marcación directa de la pieza
6. ¿Qué es el número de artículo comercial global (GTIN)?
Un GTIN es un número de identificación GS1 único globalmente que se utiliza para identificar a un artículo comercial. El propietario de la marca (etiquetador) asigna los GTIN del producto y se utilizan para identificar los productos a medida que pasan por la cadena de suministro global hasta que llegan al usuario final, como un hospital. Si no está utilizando actualmente el sistema GS1 con GTIN para administrar sus productos, tendrá que obtener los GTIN para los productos que está adquiriendo.
Para obtener más información sobre GTIN, póngase en contacto con GS1 en: https://www.gs1us.org/resources/standards..
7. ¿Cómo obtengo los GTIN de producto?
Envíe un correo electrónico al Servicio al cliente de Masimo:
EE. UU.: customerorders@masimo.com
Fuera de EE. UU.: emeasales@masimo.com
Incluya su ID de cliente y los números de pieza del producto en el correo electrónico.
8. Estoy especificando o escaneando actualmente los códigos de barras de referencia o de lote de Masimo en la etiqueta. ¿Es posible que se produzcan interrupciones?
Sí. Los códigos de barra de lote o referencia de la etiqueta se quitarán y se sustituirán por texto y ya no podrán escanearse. Para obtener información sobre el lote, tendrá que escanear el código de barras GS1 o ubicarlo junto al símbolo de lote en la etiqueta. La información de referencia puede identificarse en el GTIN correspondiente. Para obtener más información sobre GTIN, consulte la pregunta n.º 6 de arriba.
9. ¿Los números de productos Masimo cambiarán cuando se implemente el etiquetado UDI?
No, los números de productos Masimo seguirán siendo los mismos.
10. ¿Cuál es el nuevo formato de fecha estandarizado y cuándo entrará en vigor?
La regla sobre el UDI adoptó el formato de fecha estandarizado AAAA-MM-DD en las etiquetas de los dispositivos. Las fechas de los dispositivos estarán en el nuevo formato no más tarde de la fecha en la que la etiqueta del dispositivo debe mostrar un UDI. Para obtener más información sobre la planificación de la implementación, consulte la pregunta n.º 3 anterior.
11. ¿Masimo proporcionará información del producto en línea?
La GUDID es una base de datos de búsqueda pública que contiene la parte de la identificación del dispositivo (DI) del UDI de todos los dispositivos médicos, así como otra información de producto necesaria. Todas las empresas de dispositivos médicos deben enviar la información de DI a la GUDID. Masimo ha comenzado a completar la GUDID y garantizará que todos los productos se agreguen de acuerdo con la programación de la implementación del UDI o por adelantado.
12. ¿Qué ocurre con los inventarios existentes? ¿Los fabricantes tienen que volver a marcarlos?
No, hay dos excepciones para los inventarios existentes:
- Los dispositivos de distribución comercial anteriores a la fecha de cumplimiento aplicable no tienen que cumplir con la regla final.
- Los dispositivos fabricados y etiquetados antes de la fecha de cumplimiento aplicable también están exentos del cumplimiento. Sin embargo, esta excepción caduca 3 años después de la fecha de cumplimiento aplicable.
13. ¿Todos los dispositivos tienen que marcarse directamente con sus UDI?
No. La regla solo requiere marcación directa para los dispositivos médicos reutilizables que tienen que reprocesarse (limpieza de alto nivel/esterilización) antes de volver a usarlos.
Masimo está aplicando la marcación directa de las piezas de todos los productos reutilizables de forma voluntaria. No es necesario aplicar la marcación directa de los productos Masimo según la regla actual de la FDA. Para obtener más información sobre la programación de la implementación de la marcación directa, consulte la pregunta n.º 3 arriba.
Para obtener más información sobre el sistema UDI, visite la sección de identificación única de dispositivo (UDI) en el sitio web de la FDA:
http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/UniqueDeviceIdentification/.
Si tiene preguntas adicionales sobre la forma en la que Masimo está cumpliendo con sus regulaciones UDI, póngase en contacto con el Servicio al cliente de Masimo en:
EE. UU.: customerorders@masimo.com
Fuera de EE. UU.: emeasales@masimo.com
PLCO-001927/PLMM-10045C-0818